
EMSA陰陽對照
| 對照類型 | 產品描述 | 目錄號 | 產品包裝 | 價格/元 |
|---|---|---|---|---|
| EMSA-PNEMSA |
特異性陰陽性對照 | SIDET501a |
各6次上樣 | 800 |
| SIDET501b | 各10次上樣 | 1250 | ||
| EMSA-PCEMSA |
特異性陽性對照 | SIDET502a |
6次上樣 | 650 |
| SIDET502b | 10次上樣 | 970 | ||
|
EMSA-NCEMSA |
特異性陰性對照 | SIDET503a | 6次上樣 | 330 |
| SIDET503b | 10次上樣 | 508 |
-
一、為什么需要EMSA陰性陽性對照
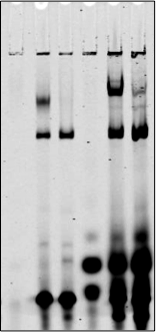
-
通過電泳技術確定目標分子位置時,一般都會放分子量參考物。Western Blotting (WB)使用蛋白分子量Marker,DNA/RNA電泳使用DNA/RNA 分子量Markers 來確定目標分子的位置。 在蛋白與核酸電泳分析中不用Marker會導致無法確認目標分子。同樣,在EMSA測定中,不用參照物會造成結果分析困難。
-
EMSA是用非變性膠來分析天然蛋白遷移率。在非變性膠中的蛋白遷移率受許多因素影響;
1)蛋白分子量大的移動慢。但由于EMSA的PAGE 膠濃度很低(相對于WB的濃縮膠),對大蛋白的分離遠不及WB。
2)天然蛋白質的3D構型會影響電泳遷移率;小的絲狀蛋白可能比分子量大很多的球形蛋白移動慢。
3)蛋白質所帶電荷的極性與強弱會影響電泳遷移率; 帶負電荷多的移動快。
4)蛋白與蛋白結合會遷移率;如多數轉錄因子都需與別蛋白結合而發揮作用。
5)蛋白與不同類型探針結合遷移率會有差別。非放射性標記探針的標記物也會影響目標蛋白遷移率。
-
二、如何制備或獲得EMSA對照
-
做EMSA的目的不是用來判斷目標蛋白大小,而是找出核酸/蛋白復合物的位置。因而,在EMSA膠中放分子量Marker沒有用,也不能WB的Marker。 一般會在實驗時,同時進行EMSA陰性陽性對照的結合反應,一起跑電泳。制備EMSA對照,尤其陽性對照,可以參照文獻,采用大家公認的方式進行并且經過EMSA確認。
以我們做的NFkB對照為例,陽性對照的制備如下;培養Mo7e細胞3天左右,頭天放無血清培養基過夜,第二天上午用腫瘤壞死因子(TNF-a)處理1小時,然后抽提核蛋白, 測定蛋白濃度,做NFkB的EMSA分析。陽性樣品分裝后放-80oC保存。即使這樣處理,仍然有25%的幾率,NFkB的EMSA結果為陰性,可能與細胞生長有關。
三、如果選擇EMSA對照
(1)如有可能,盡量選用與實驗蛋白因子相同的EMSA對照,有以下好處;1)能夠準確指示目標帶的位置,2)使用相同探針有助于確定實驗條件,3)容易找出EMSA測定中的問題,4)帶陰陽對照的圖譜可以一起發表。
(2)當制備與實驗蛋白因子相同的對照不易或不可行時,也可采用以結合蛋白位置相近的已知陽性結合蛋白做對照(實際上,WB與核酸電泳中的分子Marker都實驗樣品不同), 但陽性對照與實驗樣品的物種來源不要差別太大。對動物與人的許多轉錄因子而言,陽性結合帶都會出現在特定區域,許多都可以互作對照。如果客戶對位置判斷有問題,微奧基因可以協助解決。
(3)如果陽性對照的結合帶位置與EMSA目標分子差別很大,作為陽性對照的意義不大。Thermo公司的Lightshift 中的EBNF陽性對照就沒有什么實際意義;
1)EBNF結合帶位置比非特異結合帶都低,位于游離探針上面一點,不能幫助判斷絕大多數DNA/RNA結合蛋白的位置。
2)EBNF對照所用探針與樣品與實驗測定完全不一樣。EMSA實驗結果未達預期可能是由于核蛋白丟失,蛋白降解,蛋白因子未活化,探針不結合等原因,但與EBNF對照有無結合帶出現半毛錢關系都沒有。
3)在同一片膠中用EBNF對照的理由是可確定電泳與測定系統是否工作。理論上,如果跑電泳,轉膜,紫外交聯,Biotin/Avidin反應,或ECL底物出問題,就可能看不到EBNF結合帶。但實際上,出現上述問題時,游離探針也會看不到,何必要看EBNF帶。
4)在把實驗圖用于文章發表時,需要將EBNF對照帶切掉。如果用于發表的圖中實驗樣品都有了結合帶,還用得著用EBNF對照來證明EMSA檢測系統是否工作嗎?!四、微奧基因的EMSA對照與價格
微奧基因所有的陽性與陰性對照的數量與類別為業界最全,所有的陽性與陰性對照都經過EMSA測定,保證品質。現有的陽陰性對照有NFkB,AP1,SP1,OCT1,OCT2,OCT2,NRF2,GATA,STATs,WT-1,EF2,P53,GLI,Burnx1等...

 客服一號
客服一號
